类器官来源于成体干细胞或多能干细胞,可分化为多种细胞类型,形成类似体内器官的结构。将类器官与微生物进行共培养,可以在体外重现宿主 - 微生物的相互作用,有助于深入理解微生物在健康和疾病中的作用机制。例如,肠道类器官可以与肠道微生物共培养,研究肠道菌群对肠道上皮细胞的影响,以及肠道上皮细胞对微生物的调控作用。
今天小编整理了一些关于类器官与微生物共培养的问题,希望能够对各位小伙伴有所帮助。
类器官可以与多种微生物进行共培养。
细菌:结直肠癌类器官与具核梭杆菌(Fusobacterium nucleatum, Fn)共培养后,可验证Fn的代谢产物(NaB)加强了PD-1抑制剂对肿瘤的杀伤效果[1];
病毒:Calvin J. Kuo等人[2]建立了顶端朝外的远端肺脏类器官,其暴露的外表面上表达ACE2促进了SARS-CoV-2感染,可作为人类远端肺部感染(包括与COVID-19相关肺炎)的体外类器官模型;
真菌:烟曲霉分生孢子或其细胞壁成分通过PRR信号通路触发肺类器官的强烈炎症反应,可为真菌性肺炎的机制研究提供模型[3];
寄生虫:隐孢子虫可成功感染并定植于人小肠与肺来源的上皮类器官中,该类器官模型能支持寄生虫的侵入与存活,模拟生理性感染过程[4]。
目前,关于微生物感染类器官的方法主要有以下几种:
可以。目前在疫苗研发应用最广的是扁桃体类器官,利用类器官样本与流感等抗原共同孵育,结合基线血液和组织多维度测试,分析不同时间点免疫细胞组成和激活、抗体特异性以及中和能力等[17]
1. 为了确保微生物能在适宜的环境下与类器官进行共培养,需要避免添加抑制其生长的抗生素;
2.对于厌氧微生物的共培养,需要调整氧气浓度[5];
3.根据微生物的需求,可额外补充碳源/氮源或其他代谢底物。
1、用荧光染料对微生物进行染色,有些可以追踪它们在共培养中的行为长达1周[5]。
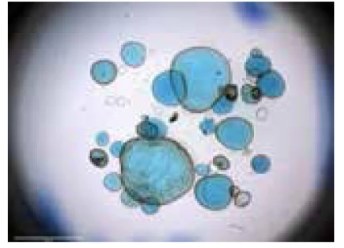
图1. 显微注射法实现微生物与类器官共培养[5]
2、也可以采用电镜的方式直接观察[18]。
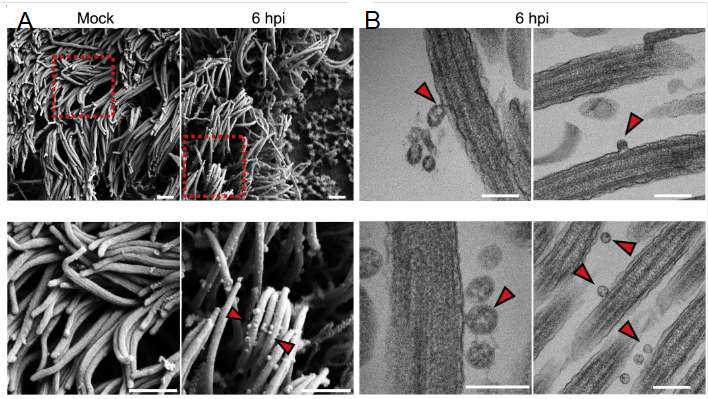
图2. 利用SEM(A)和TEM(B)观察被病毒感染前(Mock)和感染后6小时(6 hpi)的类器官纤毛部分,箭头部分为病毒[18]
3、还可以将类器官提取RNA,检测微生物的16S rRNA的表达水平,在宿主细胞的管家基因归一化之后即可表示感染情况[6] 。
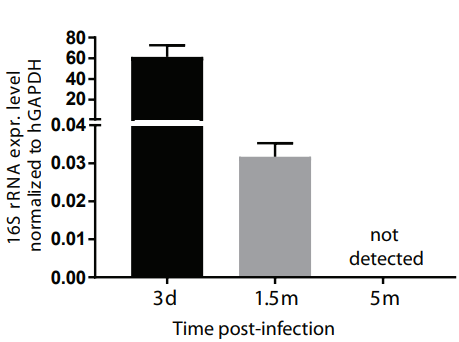
图3. 检测16S rRNA表达水平评估细菌感染类器官的强度[6]
4、可以利用现有的滴度检测方法,如Rotavirus Fluorescent Focus Assay (FFA)可以检测轮状病毒的产量[19]。
大体流程是一样的,只是类器官的培养体系可能需要额外的操作步骤,如:对于非分泌型微生物,如果宿主类器官是包埋在基质胶内培养的,需要先将基质胶消化后,再进行收集或提取。
有这样的微生物,如:诺如病毒(Norovirus, NV)。诺如病毒于1972年由Kapikian等在美国诺瓦克市腹泻暴发事件中首次分离,NV只能使用类器官培养主要是有以下几个原因:
1、该病毒可在肠上皮细胞中检测到,但在传统细胞系中难以稳定复制;
2、该病毒具有高度物种专一性,无法通过常规实验动物模拟人类感染;
3、而经过实验验证,该病毒可以感染肠道类器官并且实现有限复制[20]。
基于类器官独特的3D结构,有些实验是无法用二维细胞完成的:
1、特定微生物的体外扩增只能在类器官中完成,如上文提到的诺如病毒[20];
2、类器官的三维结构可以用于模拟体内的微生物定植环境,进行微生物定植相关的研究[21];
3、细胞系的基础性质与它们来源的细胞有很大差异,如:肝细胞系与其相关的原代细胞进行比较时,观察到转录组学和蛋白质组学表达的偏差[22],可能影响感染数据的准确性;
4、由于类器官的药敏测试与临床结果更接近,因此在抑菌/抑制病毒等药物的研发、以及引入免疫细胞后的免疫效果评估会更准确。
感染前的微生物最好做一些数量及活性的评估,以下步骤可按需选择:
1、确保微生物结构的完整性;
2、确保微生物的活力:细菌在感染前可以先做生长曲线,最好在对数期时使用;真菌可选择钙荧光白(CFW)染色确认活性;寄生虫可以在显微镜下确定数量与发育阶段,并在镜下观察蠕动或游动;
3、预实验确定MOI,之后可按需选择浓缩步骤。
Toshiro Sato等人[23]开发了一种名为 iHACS(肠道半厌氧共培养系统)的新技术,它可以模拟人类结肠上皮细胞和肠道厌氧菌的共生环境。该系统包含一个低氧的顶端室和一个常氧的基底室,允许厌氧菌在低氧环境下生长,同时维持上皮细胞的活力。
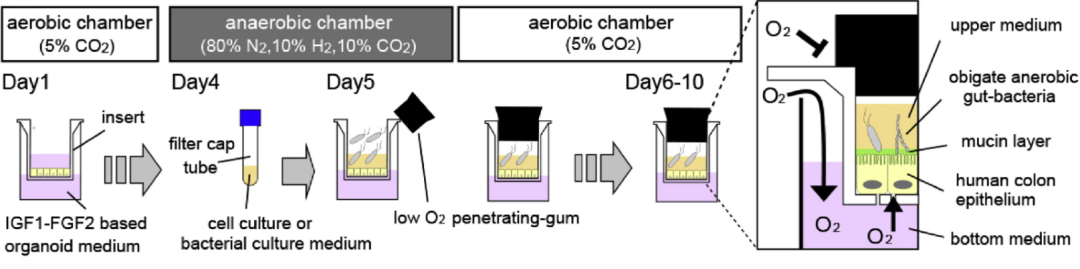
图4. 使用Transwell的肠类器官和厌氧微生物群的共培养体系示意图[23]
⭐ 相关产品
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
参考文献
[1]Wang, X. et al. (2024). Fusobacterium nucleatum facilitates anti-PD-1 therapy in microsatellite stable colorectal cancer. Cancer Cell, 42(10), 1729-1746.
[2]Salahudeen, A. et al. (2020). Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature, 588(7839), 670-675.
[3]Bosáková, V. et al. (2023). Activation of TLRs by opportunistic Fungi in lung organoids. In Toll-Like Receptors: Methods and Protocols (pp. 271-284). New York, NY: Springer US.
[4]Heo, I. et al. (2018). Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature microbiology, 3(7), 814-823.
[5]Puschhof, J. et al. (2021). Intestinal organoid cocultures with microbes. Nature protocols, 16(10), 4633-4649.
[6]Kessler, M. et al. (2019). Chronic Chlamydia infection in human organoids increases stemness and promotes age-dependent CpG methylation. Nature communications, 10(1), 1194.
[7]Stroulios, G. et al (2021). Culture methods to study apical-specific interactions using intestinal organoid models. Journal of Visualized Experiments (JoVE), (169), e62330.
[8]Stroulios, G. et al. (2022). Apical-out airway organoids as a platform for studying viral infections and screening for antiviral drugs. Scientific reports, 12(1), 7673.
[9]Cho, Y.. et al. (2024). Establishment of an Apical-Out Organoid Model for Directly Assessing the Function of Postbiotics. Journal of Microbiology and Biotechnology, 34(11), 2184.
[10]Ahmad, V. et al. (2024). Development of polarity-reversed endometrial epithelial organoids. Reproduction, 167(3).
[11]Jenal, U. (2024). Pseudomonas aeruginosa breaches respiratory epithelia through goblet cell invasion in a microtissue model. Nature Microbiology, 9(7), 1725-1737.
[12]Aguilar, C. et al. (2021). Organoids as host models for infection biology–a review of methods. Experimental & Molecular Medicine, 53(10), 1471-1482.
[13]Sachs, N. et al. (2019). Long‐term expanding human airway organoids for disease modeling. The EMBO journal, 38(4), e100300.
[14]Horsley, H. et al. (2018). A urine-dependent human urothelial organoid offers a potential alternative to rodent models of infection. Scientific reports, 8(1), 1238.
[15]Boccellato, F. et al. (2019). Polarised epithelial monolayers of the gastric mucosa reveal insights into mucosal homeostasis and defence against infection. Gut, 68(3), 400-413.
[16]Alonso-Roman, R. et al. (2024). Organ-on-chip models for infectious disease research. Nature microbiology, 9(4), 891-904.
[17]Wagoner, Z. W. et al. (2025). Systems immunology analysis of human immune organoids identifies host-specific correlates of protection to different influenza vaccines. Cell Stem Cell, 32(4), 529-546.
[18]Wu, C. T. et al. (2023). SARS-CoV-2 replication in airway epithelia requires motile cilia and microvillar reprogramming. Cell, 186(1), 112-130.
[19]Finkbeiner, S. R. et al. (2012). Stem cell-derived human intestinal organoids as an infection model for rotaviruses. MBio, 3(4), 10-1128.
[20]Hosmillo, M. et al. (2020). Norovirus replication in human intestinal epithelial cells is restricted by the interferon-induced JAK/STAT signaling pathway and RNA polymerase II-mediated transcriptional responses. MBio, 11(2), 10-1128.
[21]McCracken, K. W. et al. (2014). Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature, 516(7531), 400-404.
[22]Olsavsky, K. M. et al. (2007). Gene expression profiling and differentiation assessment in primary human hepatocyte cultures, established hepatoma cell lines, and human liver tissues. Toxicology and applied pharmacology, 222(1), 42-56.
[23]Sasaki, N. et al. (2020). Development of a scalable coculture system for gut anaerobes and human colon epithelium. Gastroenterology, 159(1), 388-390.
